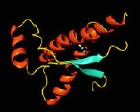
 Die räumliche Struktur von Proteinen bestimmt die Funktion von biologischen und chemischen Prozessen unseres Lebens. Ob ein Medikament gegen eine Krankheit wirkt, hängt etwa davon ab, ob es in das aktive Zentrum des hierfür verantwortlichen Proteins passt und so dessen Funktion blockieren kann. Die Kenntnis der Struktur von Proteinen und der Aminosäuren, aus denen die Proteine bestehen, ist daher von fundamentaler Bedeutung, um Prozesse unseres Lebens zu verstehen und sie im Falle von Krankheiten positiv zu beeinflussen,
Die räumliche Struktur von Proteinen bestimmt die Funktion von biologischen und chemischen Prozessen unseres Lebens. Ob ein Medikament gegen eine Krankheit wirkt, hängt etwa davon ab, ob es in das aktive Zentrum des hierfür verantwortlichen Proteins passt und so dessen Funktion blockieren kann. Die Kenntnis der Struktur von Proteinen und der Aminosäuren, aus denen die Proteine bestehen, ist daher von fundamentaler Bedeutung, um Prozesse unseres Lebens zu verstehen und sie im Falle von Krankheiten positiv zu beeinflussen,
Doch Moleküle sind zu klein, als dass man Sie photographieren könnte. Die Wellenlänge des sichtbaren Lichts, etwa 300 nm, ist viel zu groß, um die Auflösung von atomaren Abständen, etwa 0.1 nm, zu erreichen. Mit Röntgenstrahlung, also Strahlung einer Wellenlänge im Bereich von Atomabständen, bekommt man ein scharfes Photo eines Moleküls, aber nur dann, wenn es auch still hält. Dieses "still halten" erreicht man dadurch, dass man das Molekül kristallisiert. Nun sind aber - trotz großer Erfolge auf diesem Gebiet, die sicher auch in naher Zukunft mit einem Nobelpreis ausgezeichnet werden sollten - Proteine recht unwillig, einen schönen Kristall zu bilden. Darüber hinaus findet unser Leben nicht in festen Kristallen, sondern in Lösung statt, etwa im wässrigen Inneren einer Zelle. Die räumliche Struktur eines in Wasser gelösten Proteins kann vollkommen anders sein als im Kristall.

 Drei Forscher erhielten in diesem Jahr den Nobelpreis für die Entwicklung von Methoden, die die Aufklärung von Proteinstrukturen ermöglichen. Dabei wurden zwei grundsätzlich verschiedene Methoden gewürdigt. John B. Fenn (Abbildung links), Virginia Commonwealth University, Richmond, USA, und der erst 1959 geborene Entwicklungsingenieur Koichi Tanaka (Abbildung rechts) von der Firma Shimadzu, Japan, teilen sich eine Hälfte des Nobelpreises. Ihnen gelang die Weiterentwicklung der in der Chemie gut etablierten, so genannten Massenspektrometrie, die nun auch die Untersuchung von Proteinen ermöglichte.
Drei Forscher erhielten in diesem Jahr den Nobelpreis für die Entwicklung von Methoden, die die Aufklärung von Proteinstrukturen ermöglichen. Dabei wurden zwei grundsätzlich verschiedene Methoden gewürdigt. John B. Fenn (Abbildung links), Virginia Commonwealth University, Richmond, USA, und der erst 1959 geborene Entwicklungsingenieur Koichi Tanaka (Abbildung rechts) von der Firma Shimadzu, Japan, teilen sich eine Hälfte des Nobelpreises. Ihnen gelang die Weiterentwicklung der in der Chemie gut etablierten, so genannten Massenspektrometrie, die nun auch die Untersuchung von Proteinen ermöglichte.
 Kurt Wüthrich (Abbildung links), ETH Zürich und Scripps Research Institute in La Jolla, gelang die Weiterentwicklung der Kernresonanzspektroskopie (NMR), einer Methode, die für die Analyse kleiner Moleküle in der Chemie und auch in der Medizin als Bild gebendes Verfahren (Magnetic Resonacne Imaging, MRI) unschätzbare Dienste leistet. Die Anwendung dieser Methode für die dreidimensionale Darstellung von Proteinen in Lösung bedeutete das Erklimmen des Olymps im Bereich der Analytik von Biomolekülen.
Kurt Wüthrich (Abbildung links), ETH Zürich und Scripps Research Institute in La Jolla, gelang die Weiterentwicklung der Kernresonanzspektroskopie (NMR), einer Methode, die für die Analyse kleiner Moleküle in der Chemie und auch in der Medizin als Bild gebendes Verfahren (Magnetic Resonacne Imaging, MRI) unschätzbare Dienste leistet. Die Anwendung dieser Methode für die dreidimensionale Darstellung von Proteinen in Lösung bedeutete das Erklimmen des Olymps im Bereich der Analytik von Biomolekülen.
Artikel zum Thema:
Streit um den Nobelpreis Chemie 2002 | Nobelpreis Chemie 2005 | Nobelpreis Chemie 2004 | Nobelpreis Chemie 2003 |Nobelpreis Chemie 2001